内分泌治疗是激素受体阳性(HR+)的乳腺癌辅助治疗的主要手段,近几十年来,随着内分泌治疗药物不断的创新与发展,从最早的选择性雌激素受体调节剂类药物治疗,到芳香化酶抑制剂 (AI)时代的建立再到AI+时代到来,治疗模式不断改变。上世纪90年代后期,随着几项大型临床试验的开展及结果公布,AI逐渐取代了他莫昔芬的“金标准”地位,成为绝经后HR+早期乳腺癌起始辅助内分泌治疗的标准方案。
目前临床上有三种AI:以阿那曲唑、来曲唑为代表的非甾体类AI和以依西美坦为代表的甾体类AI,它们在疗效及安全性上是否存在差异?大型头对头比较的研究FACE和MA.27,以及3种AI比较的研究FATA-GIM3回答了这个问题。
头对头研究:三种AI疗效无明显差异
FACE研究是一项IIIb期、开放、多中心研究,纳入4136例绝经后激素受体阳性(HR+)、淋巴结阳性的乳腺癌患者,随机1:1分配到5年辅助来曲唑(2.5 mg,n=2061)或阿那曲唑(1 mg,n=2075)治疗,主要研究终点是5年的无病生存期(DFS),次要终点包括安全性和总生存期(OS)结果,中位随访60个月[1]。
来曲唑和阿那曲唑的5年DFS分别是84.9% 和 82.9%[HR=0.93 (95% CI: 0.80–1.07); P= 0.3150];5年OS分别是89.9%和89.2% [HR= 0.98 (95% CI: 0.82–1.17),P= 0.7916]。根据BMI(<29、29-35、>35)、之前是否接受辅助化疗、分期、HER2状态及不同区域等的亚组分析中,两组间均未显示显著统计学差异。FACE研究结果显示,在HR+绝经后淋巴结阳性的乳腺癌患者中,来曲唑和阿那曲唑在DFS和OS上疗效相当。

图1 FACE研究DFS结果

图2 FACE研究OS结果
随着FACE研究结果的公布,既往认为“来曲唑使高危患者获益及较其他AI有OS延长优势”的假设随即被阿那曲唑推翻。对于激素受体阳性、淋巴结阳性的绝经后患者来说,来曲唑与阿那曲唑的疗效或安全性相当。
此外,对于低危的乳腺患者而言又该如何选择AI呢?BIG1-98研究首次报道25.8个月中位随访结果显示,无论在T≤2cm、淋巴结阴性或者ER+/PgR-患者中,与他莫昔芬组相比,来曲唑组均未见显著获益;而且BIG1-98研究在中位随访71个月、74个月和8.7年的单药分析中发现,对于淋巴结阴性等低危患者来说,来曲唑组与他莫昔芬组获益无显著差异[2]。而ATAC研究首次报道的33.3个月随访的亚组结果显示,无论在淋巴结阴性还是在既往未接受化疗的患者中,均可见阿那曲唑组与他莫昔芬组之间具有显著差异。在后续的长期随访中,ATAC研究中位随访100个月的亚组分析再次验证了此结论[3]。因此,对于低危绝经后乳腺癌患者而言,较来曲唑而言,阿那曲唑的获益更加明显。
MA.27是一项比较依西美坦与阿那曲唑剂在治疗HR+早期乳腺癌疗效的Ⅲ期临床研究[4]。该研究自2003年5月到2008年7月共纳入7576名乳腺癌患者,其中99%的患者ER受体阳性,并且72%的患者肿瘤直径临床分期为T1,患者随机分配到阿那曲唑组(1mg/d)和依西美坦组(25mg/d)为期5年的治疗中。研究主要终点为无事件生存率(EFS),次要终点为无远处转移生存率(DDFS),同时就骨质疏松与抗骨质疏松治疗对两者的影响进行了探索性分析。
中位随访4.1年时,依西美坦与阿那曲唑在治疗激素受体阳性早期乳腺癌的EFS相当(HR 1.02,95%CI 0.87~1.18,P=0.85)。这意味着,研究未达到预期结果,并未证明依西美坦显著优于阿那曲唑。分层分析结果亦显示,无论淋巴结状态还是既往是否接受过辅助化疗,依西美坦组的EFS都不优于阿那曲唑组,同时次要终点OS和DFS也未见明显差异。
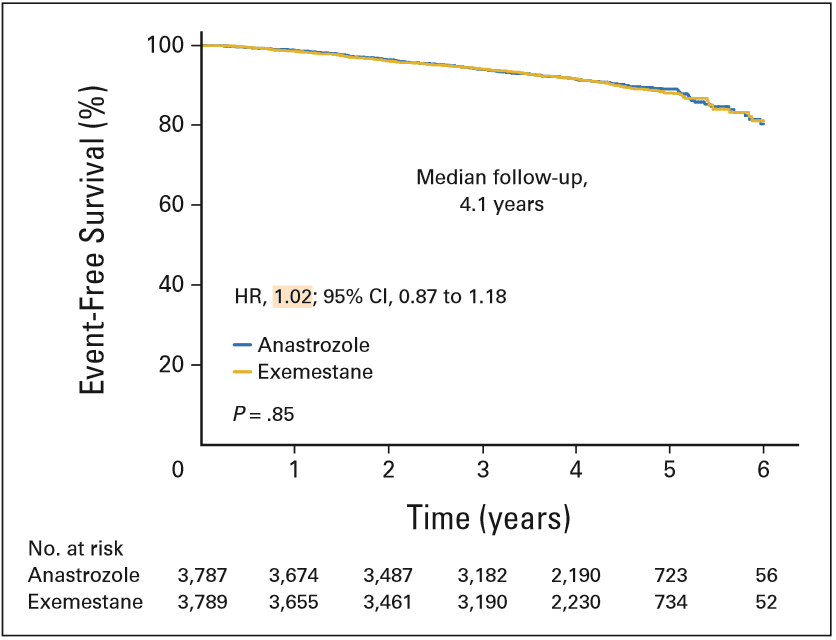
图3 依西美坦与阿那曲唑EFS相当
2018年《Lancet Oncology》在线发表了III期FATA-GIM3研究的结果[5],在绝经后早期乳腺癌患者中比较了两种辅助内分泌治疗模式和阿那曲唑、来曲唑、依西美坦3种AI类药物的疗效差异。FATA-GIM3是一项多中心、开放标签、随机、三期试验,患者分配至以下6个治疗组:1. 直接使用AI治疗5年策略:阿那曲唑(1mg),来曲唑(2.5mg),依西美坦(25mg);2. 序贯治疗组:TAM 20mg/d使用2年后分别序贯三种AI治疗3年。主要研究终点为DFS。
在中位随访60个月后,5年DFS率序贯治疗组为88.5%(95%CI:86.7-90.0)和直接使用AI组为89.8%(88.2-91.2),两组无统计学差异(HR=0.89,95%CI:0.73-1.08;P=0.23)。进一步对比不同AI治疗组,5年DFS率阿那曲唑为90.0%(95%CI:87.9-91.7),来曲唑组为88.0%(95%CI:85.8-89.9),依西美坦组为89.4%(87.3-91.1),3组无统计学差异(P=0.24)。

图3 依西美坦与阿那曲唑EFS相当
FATA-GIM3研究进一步证实了在绝经后早期乳腺癌患者治疗中,阿那曲唑、来曲唑、依西美坦并未发现疗效上的差异。
安全性:阿那曲唑心血管安全性更胜一筹
现有的证据表明三种AI在乳腺癌辅助内分泌中的疗效并无明显差异,那么,三种AI在不良反应方面有无差异呢?
早期绝经后乳腺癌患者长时间接受内分泌治疗,受卵巢功能抑制和AI的双重作用,雌激素水平大幅减退,势必会增加患者罹患动脉粥样硬化性心血管疾病的风险。在两项头对头研究中,由于FACE研究的提前终止,来曲唑和阿那曲唑两组患者治疗相关不良反应未见明显差异,MA.27研究中,依西美坦组房颤等不可逆严重不良事件发生率较阿那曲唑显著更高。ATAC研究显示,相比他莫昔芬,阿那曲唑不增加心血管事件(P=0.1),且显著减少血栓栓塞性事件(P=0.0004)和脑卒中(P=0.03)[3]。而BIG1-98研究结果显示,他莫昔芬组与来曲唑组的心脏不良事件发生率相似,但来曲唑组3~5级心脏不良事件发生率明显增高[4]。TEAM研究显,依西美坦较他莫昔芬有高血压事件增多的趋势[6]。
从机理出发,三种AI在抑制雌激素程度上存在一些差别。第三代AI治疗能够达到雌激素抑制的阈值,即具有良好临床疗效的阈值。在此阈值基础上进一步降低雌激素水平不会明显增加疗效,但可能增加心血管不良事件,从而导致内源性雌激素的降低与心血管疾病风险增加相关。多项研究已证明三种AI的心血管安全性存在差异。整体而言,患者使用阿那曲唑之后心脑血管发生率低,依从性较好。在临床应用中,我们应该要综合考虑患者的情况,选择依从性较高的药物。
于此同时,患者在服用AI药物治疗时,也可进行相应的心血管事件风险管理。一般认为,高龄、高血压、高密度脂蛋白胆固醇(HDL-C)水平偏低,或低密度脂蛋白胆固醇(LDL-C)水平偏高为主要的心血管事件危险因素。低心血管事件风险的患者,可通过健康饮食、锻炼和戒烟等措施进行预防;而高心血管事件风险的患者,进行健康饮食、锻炼和戒烟的同时,应尽早在医生的指导下进行降压和调血脂治疗。
由于雌激素水平降低与骨折风险增高显著相关,正常绝经后女性自然骨折发生风险是男性的2倍。乳腺癌患者在治疗过程中存在许多导致骨丢失的危险因素,包括绝经后状态、AI治疗、化疗、卵巢切除或应用药物抑制卵巢功能人工诱导至绝经后状态等。随着AI在乳腺癌辅助治疗中的广泛应用,以及乳腺癌患者生存期的延长,应用AI的患者骨关节事件的管理也越来越重要。
在骨安全性方面,MA. 27研究显示阿那曲唑与依西美坦两组临床骨折和脆骨性骨折发生率无差异。依西美坦的雄激素样结构可能与轻度肝损害、雄激素样反应等事件有关。在治疗3年时,两组各有约1/4的患者中断治疗,两种药物的依从性无差异。
表1 MA. 27研究中依西美坦和阿那曲唑不良事件比较

在后续的MA.27b研究中,纳入497例在MA.27随机后25周内接受双能X线骨密度仪扫描检测脊椎和髋部骨密度(BMD)的T评分的患者,以2年脊髓和髋部BMD的T评分变化为主要终点,无论是髋部还是腰椎两组患者T评分变化均未见显著差异。该研究结果进一步证实在骨关节事件上,阿那曲唑与依西美坦无明显差异。
另外,在FATA-GIM3研究中,阿那曲唑、依西美坦、来曲唑三种AI的骨关节事件也未见明显差异[5]。
表2:FATA-GIM3研究骨事件安全性结果

值得注意的是,权威指南和共识对于接受AI治疗的乳腺癌患者的骨安全管理也有相应推荐,患者可以根据发生骨事件的风险分级,推荐采取补充钙剂和维生素D、使用双膦酸盐治疗等预防措施和处理方法,在药物治疗的同时,患者也可以进一步加强骨密度检测频率。
小结:
1999年,阿那曲唑进入中国,经中国国家药品监督管理局批准用于绝经后妇女激素受体阳性的早期乳腺癌的辅助治疗等适应证,并且随着循证证据的积累,适应证得到了不断扩大和更新;随后来曲唑获批用于绝经后激素受体阳性早期乳腺癌患者以及已接受过标准他莫西芬辅助治疗后的延长治疗,依西美坦获批用于既往接受过2~3年他莫西芬治疗后换药的绝经后早期乳腺癌的辅助治疗。
目前,对于绝经后乳腺癌患者首选仍为AI类药物治疗,阿那曲唑在华应用于临床已有二十一载,积累了丰富的乳腺癌临床治疗证据,相信会持续在我国早、晚期乳腺癌治疗中发挥重要作用。
参考文献:
[1] Ian Smith et al.Comparative Efficacy and Safety of Adjuvant Letrozole Versus Anastrozole in Postmenopausal Patients With Hormone Receptor-Positive, Node-Positive Early Breast Cancer: Final Results of the Randomized Phase III Femara Versus Anastrozole Clinical Evaluation (FACE) Trial. J Clin Oncol , 35 (10), 1041-104.
[2] Thomas Ruhstaller,et al. Adjuvant Letrozole and Tamoxifen Alone or Sequentially for Postmenopausal Women With Hormone Receptor-Positive Breast Cancer: Long-Term Follow-Up of the BIG 1-98 Trial.J Clin Oncol , 37 (2), 105-114
[3]Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial[J]. Lancet Oncol. 2010;11(12):1135-41.
[4] Paul E Goss, et al. Exemestane Versus Anastrozole in Postmenopausal Women With Early Breast Cancer: NCIC CTG MA.27--a Randomized Controlled Phase III Trial. J Clin Oncol , 31 (11), 1398-404.
[5] Sabino De Placido, et al. Adjuvant anastrozole versus exemestane versus letrozole, upfront or after 2 years of tamoxifen, in endocrine-sensitive breast cancer (FATA-GIM3): a randomised, phase 3 trial. Lancet Oncol 2018; 19: 474–85.
[6] Derks MGM, Blok EJ, Seynaeve C, et al. Adjuvant tamoxifen and exemestane in women with postmenopausal early breast cancer (TEAM): 10-year follow-up of a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol. 2017 Sep;18(9):1211-1220.
审批编号 CN-49427





 京公网安备 11010502033352号
京公网安备 11010502033352号