编者按:6月13~16日,第24届欧洲血液学会(EHA)年会在荷兰阿姆斯特丹火热举行。作为欧洲血液学领域规模最大的国际性会议,它每年吸引来自全球100多个国家的10000余名专业人士与会,全球最前沿的研究进展和临床经验经过严格的选拔与筛选,才最终得以在大会上亮相。能够登上EHA年会这一舞台,代表着血液学领域最高的学术水平。本刊特邀请中山大学附属肿瘤医院梁洋教授针对本届大会在急性髓系白血病(AML)领域涌现出的最新临床研究进行了综述和点评。

梁洋教授在EHA现场
伴有t(8; 21)的 AML微小残留病的规范化检测-来自AML研究组的结果

研究背景:伴有 t(8; 21)(q22; q22.1)的急性髓性白血病(AML)属于WHO分型中“AML伴有复发遗传异常”类别的独特实体,在欧洲白血病协作组(ELN)2017年危险分层中,将其视为预后良好的AML亚类。尽管大多数患者在强化化疗后达到完全缓解(CR),但是约50%的病例会发生复发并且与预后不良相关。在该AML亚类中,已经显示对微小残留病(MRD)的监测可以识别具有较高复发风险的患者。
研究目的与方法:本研究旨在通过对 155名接受标准治疗的t(8; 21)AML患者的骨髓及外周血进行MRD监测,评估其对预后的影响。通过RT-qPCR进行RUNX1-RUNX1T1转录本水平(TL)的定量。 TL的定义为每106个管家基因B2M 转录本中可检测到的RUNX1-RUNX1T1的标准化值。每次实验重复三次,测定灵敏度高达10-6。
研究结果:治疗前的RUNX1-RUNX1T1 TL不影响预后,但在界定的评估时间点,RUNX1-RUNX1T1 TL的下降程度或达到MRD阴性(MRDneg),具有重要的预后提示作用。
首先,治疗1周期后实现MR2.5(> 2.5的对数值减少)和第2周期后MR3.0的实现与复发风险降低显着相关(分别为P=0.034和P=0.028);其次,完成治疗后,骨髓和外周血是否能达到MRDneg,是累积复发发生率( MRD阴性对比MRD阳性,4年CIR BM:17%vs 36%,P=0.021; PB:23%vs. 55%;P=0.001)和总生存期(MRD阴性对比MRD阳性,4年OS率BM:93%vs. 70%,P=0.007; PB:87%vs 47%; P<0.0001)的独立有利预后因素;最后,通过随访期间的动态RT-qPCR检测显示,对以下患者具有复发提示意义:骨髓中 RUNX1-RUNX1T1 TL超过150的77%的患者,以及外周血的 RUNX1-RUNX1T1 TL超过50的84%的患者。
此外,在28%的患者中观察到KIT突变,预示较低的CR率和较差的预后,但是其预后意义没有治疗中RUNX1-RUNX1T1 TL的动态改变重要。事实上,所有复发都发生在治疗结束后一年内(EOT),其分子复发到形态复发的潜伏期非常短,需要在此期间短时间内进行MRD密切评估。根据研究数据,建议在RUNX1-RUNX1T1阳性AML中进行以下的MRD评估指南:除了目前的ELN MRD建议外,还应在每个治疗周期后分析BM和PB,即根据EOT的MRD和随访期间的建议,建议MRD监测如下:1)MRD阴性:可以每月使用PB监测;2)MRD阳性(BM<150,PB<50):每三个月监测BM 和每月监测PB;3)MRD阳性(BM> 150和/或> 50)或MRD增加> 1-log或从MRD阴性转换为MRD阳性:每月都应进行分析BM和PB。
研究结论:基于RUNX1-RUNX1T1 的MRD监测可以区分高复发和低复发风险的患者。治疗结束后,BM和PB同时出现MRD阴性是复发风险和OS最有价值的独立有利预后因素。在随访期间,连续MRD分析允许定义预测复发的临界值。此外,考虑到几乎所有复发都发生在EOT后一年内,从分子到形态复发的潜伏期非常短,在此期间以密切的间隔形式进行MRD评估是必不可少的。
梁洋教授:Frank G. Rücker等来自AML研究组的研究,针对AML中预后良好的CBF白血病亚类,即伴有t(8;21)染色体异位的AML,探讨MRD的检测的规范化问题。t(8;21) AML容易缓解,更容易复发。在亚洲疾患者群也有类似结果。在业界也有对该类疾病是否需要进行造血干细胞移植必要性的热烈讨论。笔者认为,问题的一个关键点是如何有效的对该类疾病进行MRD的有效检测,识别 t(8;21)AML中具有高复发风险的患者,从而进行相应的提前干预和精准治疗。该研究进行了MRD的有效动态检测,为临床工作提供了非常实用的方法学推荐。
关于ELN2017危险分层指南的补充建议:染色体异常影响NPM1突变/ FLT3-ITD阴性/低表达AML的治疗预后

研究背景:当缺乏特别是高等位基因比率的fms相关酪氨酸激酶3基因内部串联重复(FLT3-ITD)时,核蛋白1(NPM1)突变被认为是急性髓性白血病(AML)的良好预后(FLT3-ITDneg / low)指标 。特别是最近的2017年ELN遗传学危险分层指南也界定该突变预示预后良好,与核型无关。本研究验证该假设的正确性。
研究目的与方法:本研究调查了伴随的细胞遗传学异常对于NPM1突变/ FLT3-ITD阴性/低表达AML中的预后影响。研究分析了核型对NPM1突变/ FLT3-ITD阴性 /低表达AML的集中治疗患者的结果的影响,这些患者来自于9个国际研究组或治疗中心前瞻性研究的登记数据库。具有来自相同数据库的伴不良细胞遗传学异常的NPM1野生 / FLT3-ITD阴性 /低表达AML患者为对照组。
研究结果:该研究分析了2426例NPM1突变/ FLT3-ITD阴性/低表达AML患者。其中2000例(82.4%)有正常核型,426例(17.6%)伴有异常核型,包括329例(13.6%)患有中危的核型异常,及83例(3.4%)高危的核型异常。在NPM1突变/ FLT3-ITD阴性 /低表达的AML患者中,不良细胞遗传学与较低的完全缓解(CR)率相关(正常,中危和高危核型分别为87.7%,86.0%和66.3%; P< 0.0001 ),不良细胞遗传学的总体生存较差(5年OS,正常,中危和高危核型分别为52.4%,44.8%,19.5%; P<0.0001),无事件生存也较差(5年EFS,正常,中危和高危核型分别为40.5%,35.8%,18.0%; P<0.0001),累积复发率较高(5年CIR,正常,中危和高危核型分别为43.6%,44.2%,51.9%; P=0.0012)。在针对已知临床病理学风险因素调整的多变量混合效应回归分析中,细胞遗传学风险为独立相关因素(所有终点P<0.0001)。在具有不良风险染色体畸变的患者中,我们发现NPM1是否突变状态对结果没有显着影响。
研究结论:这项国际合作研究表明,细胞遗传学异常是NPM1突变/ FLT3-ITD阴性/低表达AML预后的重要决定因素。最重要的是,NPM1突变/FLT3-ITD阴性/低表达患者,如果伴有不良的细胞遗传学异常,则与NPM1野生型对照组具有相同的不利预后,因此应重新进行相应的预后分层。
梁洋教授:Linus Angenendt等的研究针对权威的欧洲白血病协作组ELN2017危险分层指南,提出重要的补充意见。在ELN2017关于AML危险分层中,没有针对作者提出的NPM1突变/FLT3-ITD阴性/低表达,且同时合并预后中等或者不良的染色体核型的AML群体,进行准确的危险等级划分。在临床实践中,单纯参照ELN2017分层指南,对于上述患者有可能造成危险等级的误判和相应治疗方案的错误选择。该研究对于将来ELN相应指南的修正,提供了重要的前瞻性询证医学依据。
难治/复发AML联合免疫治疗的有效性和生物学标志物

研究背景:PD-1阳性CD8 T细胞在患有复发性AML的患者(pts)的骨髓(BM)中表达增加(Williams et al,Cancer 2018)。阿扎胞苷上调PD-1和干扰素-γ信号传导(Yang et al,Leukemia 2013)。
研究目的与方法:确定Aza + Nivo和Aza + Nivo + Ipi的安全性,反应率和总生存期(OS),并鉴定反应的免疫和分子生物标志物。入组标准:复发/难治性AML(R / R AML)患者,ECOG≤2,且有足够的器官功能,则有资格获得AZA + Nivo(队列1)。共治疗70例难治/复发AML患者。此队列已经关闭。随后的AZA + Nivo + Ipi队列开始入组患者(队列2),入组标准同队列1。Ipi按照 1mg / kg Q6周给药,联合上述已建立的AZA + Nivo方案中。该剂量的设定基于Ipi + Nivo在肺癌及黑色素瘤的给药标准。
研究结果:用Aza + Nivo处理的第1组即70例难治复发 AML患者 (Daver et al,Cancer Discovery 2018),其反应率和OS均优于MD安德森癌症中心既往以去甲基化药物为基础的临床实验历史对照组,对于治疗前低肿瘤负荷(骨髓原始细胞<20%)和早期挽救治疗组的患者,其OS的改善最为显着。类似于blinatumomab(Topp M et al,Lancet Oncology 2015)和CAR-T(Park J et al,NEJM 2018)治疗复发B-ALL的反应特征,表明多次复发后的进行性T细胞衰竭。与无应答患者(NR)相比,AZA + Nivo的应答患者(Rs)在治疗前,具有更高的骨髓 CD3 +细胞数(最佳CD3 +阈值13.2%)。
为了进一步询问Rs与NRs中T细胞的功能,我们将治疗前分选的骨髓T细胞进行了功能评估,评估系统为一个32重,包括单细胞及刺激的T细胞及细胞因子反应在内的评估体系。其中,治疗前骨髓T细胞多功能强度指数(PSI)定义为样品中多功能细胞的百分比乘以分泌的细胞因子强度,该指数在Rs和NRs之间显着不同,特别是主要由IFN-g驱动的CD4细胞(P=0.0317)。所有CR / Cri患者,而不是NR患者,其 治疗前PSI均>10,和PSI=10的患者,其OS差异有统计学意义(P=0.0018)。
队列2中,24例难治复发 AML患者入组Aza + Nivo + Ipi治疗组,中位年龄71岁(范围:26-86岁),入组患者其他信息如下:继发性AML(46%),细胞遗传学预后不良组(63%),TP53突变组(38%),之前使用基于HMA治疗的54%患者中位挽救疗程为2(范围,1-4)。2例先前进行了allo-SCT。共有 9例CR / CRi(38%)患者,另外8例(33%)达到稳定疾病状态(SD)(定义为缺乏CR,CRi,PR,MLFS;治疗至少3个月时病情稳定),以及7例(29%)是NR患者。 4周和8周的死亡率分别为0和8%。Aza + Ipi + Nivo组 vs. Aza + Nivo vs. 基于HMA的MD安德森癌症中心历史对照组,其中位OS分别为10.5,6.4和4.6个月(P=0.0025)。使用AZA + Nivo + Ipi的R / R AML的1年OS达到非常令人鼓舞的45%。在6例(25%)中观察到3/4级免疫介导的毒性,包括皮疹,肺炎和结肠炎。一例患者进入ICU抢救,但没有治疗相关死亡。其他> 2级以上的毒性无特异,主要是感染/发热性中性粒细胞减少症,以及电解质紊乱。
研究结论:具有Aza + Nivo + Ipi的CR / CRi率和OS令人鼓舞,目前正在进一步扩大研究。来自用Aza + Nivo处理的患者,治疗前骨髓CD4 T细胞的PSI,可以清楚地区分Rs对NRs(P=0.0317),表明AML中非常显著,且迄今未被充分认识的免疫多样性,以及需要基于生物标志物的AML免疫疗法。
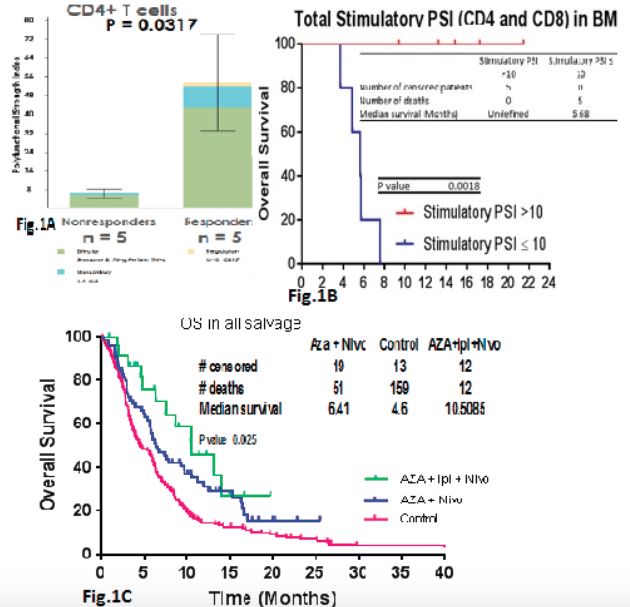
梁洋教授:Naval Daver等的研究针对难治复发AML这一类治疗领域的难点问题,进行了联合免疫检测点药物的有效探讨。由于在MDS和AML的干细胞中,前期的研究提示有PD-1以及CTLA-4的异常表达,为使用相应的免疫监测点药物提供了科学依据。本临床实验初也初步证实了相应的有效性,值得进行扩大化的临床实验,为该类患者提供更多的治疗选择并提高生存情况。
中山大学附属肿瘤医院血液肿瘤科行政负责人、研究员、博士生导师
吴阶平医学基金会精准医学学部副主任委员
亚太医学生物免疫学会血液学分会副主任委员
上海交通大学附属瑞金医院上海血液学研究所博士,专业方向急性髓性白血病的发病机制及靶向治疗
耶鲁大学肿瘤中心内科部血液系博士后,专业方向MDS发病机制
2017年被中山大学附属肿瘤医院以“百人计划”引进回国
主要研究方向:血液肿瘤的病因发病机制及靶向治疗。在Cancer Cell, Science Translational Medicine, Blood, Leukemia, PNAS, British Journal of Haematology等专业刊物发表系列临床及科研文章,累计引用次数1100余次





 京公网安备 11010502033352号
京公网安备 11010502033352号