实体瘤的肝转移是目前免疫治疗的难点,多项Meta分析结果显示PD-1/L1单抗治疗肝转移的有效率明显低于肺、淋巴结等转移部位。我国一项回顾性资料显示PD-1单抗单药治疗黑色素瘤肝转移的有效率仅为4.3%,非肝转移的有效率为20.7%。本次AACR会议报道了Tebentafusp新型药物针对转移性葡萄膜黑色素瘤(UM)的III期临床研究结果,可能改变UM肝转移的治疗现状。
研究背景
晚期黑色素瘤中最容易出现肝转移的为葡萄膜黑色素瘤,中位生存期约为1年。虽然近年来,以PD-1为代表的免疫检查点抑制剂在皮肤型黑色素瘤中获得了重大突破,但是对转移性葡萄膜黑色素瘤患者几乎无效(肝转移居多可能是耐药的重要原因)。曾有研究报道PD-1单抗单药对于转移性UM有效率约2%,双免有效率约10%。UM常伴有GNAQ、BAP-1等基因突变,但目前缺乏针对这类基因突变的靶向药物。
Tebentafusp(Tebe)是一种新型双特异性蛋白,由可溶性TCR(靶向gp100:在黑色素细胞和黑色素瘤中表达的抗原)与抗CD3免疫效应器结构域融合而成。这个蛋白相当于一个双功能杂合抗体,一头识别gp100,一头识别CD3,可以把黑色素瘤细胞拉到T细胞旁,同时完成识别和杀伤。由于这个药物是研发了针对gp-100的TCR,与TCR-T细胞治疗的原理有相似之处,因此也被戏称为“TCR疗法”。
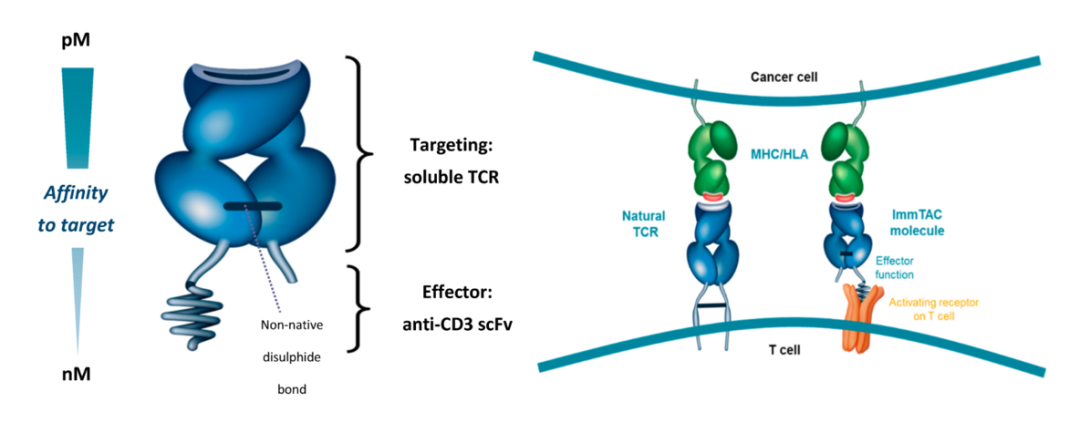
图1. Tebe分子结构(左)和作用机制(右)示意图
2020年11月在Clin Can Res上发表了该药物在UM上的I/II期临床研究数据。共纳入晚期UM患者84例,显示1年生存率为65%,γ-IFN通路细胞因子在瘤旁和瘤内均有上调,血中CXCL10增加,CXCR3+CD8+T淋巴结细胞减少,肿瘤微环境中的杀伤性T细胞增加。CXCL10升高可能与该药物导致的皮疹发生相关,初步认为皮疹的发生是有效的标志。
该研究是一项随机,开放,3期临床研究,初治HLA-A*02:01+的转移性葡萄膜黑色瘤患者(mUM)按2:1的比例随机接受Tebe或研究者选择的治疗(IC组:帕博利珠单抗、伊匹木单抗或达卡巴嗪),按LDH分层。主要终点是OS,定义为从随机化到因任何原因死亡的时间。主要研究终点:1)评估两组ITT人群中的OS;2)评估第1周期间Tebentafusp治疗的皮疹患者和所有IC治疗患者的OS。次要研究终点包括安全性和总有效率(ORR)、无进展生存率(PFS)和疾病控制率(DCR)。本次仅报道了ITT人群中的OS(第一次中期分析:截止到2020年11月)。
378名患者被随机分为tebe组(252名)或IC组:帕博利珠单抗组(103名)、伊匹木单抗组(15名)和达卡巴嗪组(7名)。在ITT人群中,Tebe较IC组显著延长OS(HR 0.51;95%CI:0.36~0.71;P<0.0001),预计1年OS率分别为73.2%(95%CI:66.3~78.9)和57.5%(95%CI:47.0~66.6)。最常见的治疗相关副反应为发热、瘙痒和皮疹。副反应在前3-4次给药后严重程度有所下降并可控。在Tebe组中,治疗相关毒性而中断治疗的比率较低(<4%),没有治疗相关死亡。
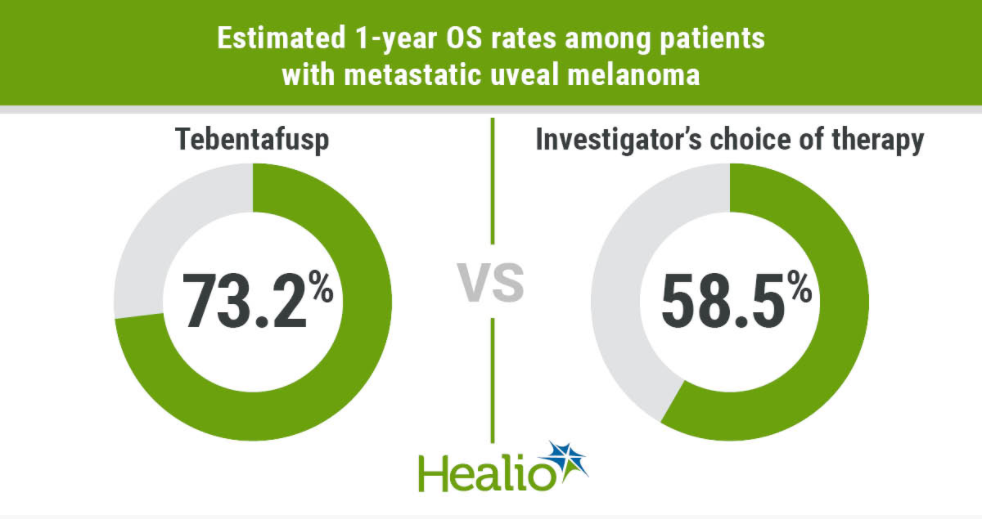
图2. Tebe组和IC组的预计1年OS率
在转移性UM的一线治疗中,tebe单药治疗显著改善OS;这是第一个可改善转移性UM生存的研究。
实体瘤肝转移是目前免疫治疗的难点,Tebentafusp可能开创了实体瘤肝转移治疗的先河,从该研究的初步结果看,葡萄膜黑色素瘤肝转移使用针对gp-100的特异性双抗延长了总体OS,非常值得期待。此前,FDA曾授予Tebentafusp快速通道认定和“孤儿药”称号。近日,美国FDA宣布已授予Tebentafusp(IMCgp100)“突破性疗法”称号,用于治疗HLA-A * 02:01基因阳性、不可切除或转移性葡萄膜黑色素瘤(mUM)成年患者。
因gp100是黑色素瘤细胞上广泛表达的抗原,将来Tebentafusp可能推广到其他类型黑色素瘤的肝转移治疗上,有望突破晚期黑色素瘤肝转移治疗的瓶颈。Tebentafusp的成功可能引发实体瘤中相似机制药物的研发和临床研究,可能在不远的将来,实体瘤肝转移的治疗将揭开新的篇章。
1. Mark R Middleton, Cheryl McAlpine, Victoria K Woodcock et al. Clin Cancer Res. 2020 Nov 15;26(22):5869-5878. doi: 10.1158/1078-0432.CCR-20-1247. Epub 2020 Aug 18
2. Xuan Wang, Qing Ji, Xieqiao Yan et al. The Impact of Liver Metastasis on Anti-PD-1 Monoclonal Antibody Monotherapy in Advanced Melanoma: Analysis of Five Clinical Studies. Front Oncol. 2020 Sep 29;10:546604. doi: 10.3389/fonc.2020.546604. eCollection 2020.3. Piperno-Neumann S, et al. Abstract CT002. Presented at: American Association for Cancer Research Annual Meeting (virtual meeting); April 10-15, 2021.4. Damato BE, Dukes J, Goodall H, Carvajal RD. Tebentafusp: T Cell Redirection for the Treatment of Metastatic Uveal Melanoma. Cancers (Basel). 2019;11(7):971.
北京大学肿瘤医院黑色素瘤内科
主任医师,博士生导师,教授
《CSCO黑色素瘤诊治指南》执笔人
《CSCO免疫检查点抑制剂相关毒性管理指南》执笔人
CSCO黑色素瘤专家委员会副主任委员
CSCO神经系统肿瘤专委会副主任委员
北京医学奖励基金会脑转移瘤专委会副主任委员
CSCO免疫治疗专委会常委
CSCO罕见肿瘤专委会常委
CSCO青年专家委员会常委
CSCO患者教育专家委员会常委
《肿瘤学杂志》青年编委副主编
《Clinical Cancer Research》审稿专家





 京公网安备 11010502033352号
京公网安备 11010502033352号